Тринитрофенол (Шимоза)
2,4,6-Тринитрофенол (пикриновая кислота) — химическое соединение C6H2(NO2)3OH, нитропроизводное фенола. Молекулярная масса 229,11 а. е. м. При нормальных условиях желтое кристаллическое вещество. Пикриновую кислоту и ее соли — пикраты — используют как взрывчатые вещества, а также в аналитической химии для определения калия, натрия.
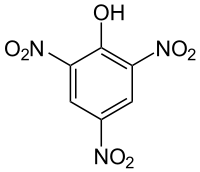
Другие названия:
мелинит (Melinite) во Франции
мелинит (Melinit) в Российской империи
лидит, или лиддит (Lyddit) в Великобритании
пертит (Pertit) в Италии
пикриновая кислота (Picric acid, PA) в США
гранатфюллюнг (Granatfullung) или Шпренгкорпер 88 (Sprengkorper 88) в Германии
пикринит, пикринита (Picrinit, Picrinita) в Испании
Экразит (Ekrasit) в Австрии
TNF в Польше, США и др.
шимозе, шимоза (яп. 下瀬火薬 симосэ каяку) в Японии
История
Предположительно, соли пикриновой кислоты (пикраты свинца и калия) обнаружил Глаубер в 1742, воздействуя азотной кислотой (методы изготовления которой он разработал) на шерсть и рог.
В 1771 г.[источник не указан 43 дня] Питер Вулф (en:Peter Woulfe) получил тринитрофенол воздействием азотной кислоты на краситель индиго. Кислотные свойства обнаружены в 1783 Гаусманом (Haussmann). Дальнейшие исследования показали образование тринитрофенола при действии азотной кислотой на различные органические вещества: шёлк, природные смолы и пр.
В 1841 Марчанд (Marchand) предложил формулу C12H6N6O14 (удвоенная формула тринитрофенола), а правильную формулу в 1842 установил Лоран (Laurent), определив, что пикриновая кислота представляет собой тринитрофенол и может быть получена нитрованием фенола. Им же был выделен динитрофенол как продукт промежуточной стадии нитрования.
В 1869 метод нитрования был усовершенствован Шмидтом и Глутцем (Schmidt, Glutz), предложившими сульфирование с последующим нитрованием. Взрывчатые свойства пикратов были обнаружены ещё в 1799 Велтером (Welter), однако до 1830-х это свойство не находило применения. Во второй половине XIX века пикраты (в основном калия и аммония) стали широко использоваться в военном деле. Длительное время сам тринитрофенол использовался как жёлтый краситель для шерсти и шёлка и не считался взрывоопасным веществом, в 1871 такой авторитетный специалист как Абель утверждал, что только пикраты обладают взрывчатыми свойствами, а тринитрофенол нет. Однако уже в 1873 Шпренгель (Sprengel) показал способность тринитрофенола к детонации, а в 1886 французский инженер Тюрпен (Turpin) обнаружил, что в сплавленном или сильно спрессованном состоянии тринитрофенол детонирует и предложил его для снаряжения боеприпасов. Это дало начало широкому применению тринитрофенола в качестве мощного бризантного взрывчатого вещества.
Первое производство бризантных артиллерийских снарядов с плавленным тринитрофенолом было налажено во Франции, а затем во многих других странах. В Российской империи производство тринитрофенола началось в 1894. В Российской империи в военном деле было принято французское название этого вещества «мелинит». Артиллерийский офицер С. В. Панпушко разработал боеприпасы для тяжёлых и полевых орудий. Во время испытательных стрельб произошло два разрыва лёгких 87-мм полевых пушек с человеческими жертвами. 28 ноября 1891 года при взрыве опытной бомбы, снаряженной мелинитом, погиб и сам С. В. Панпушко и два его помощника, вместе с ним заряжавших роковой заряд, что затормозило разработки новых вооружений в России.
Во время русско-японской войны 1904—1905 японская армия применяла в широких масштабах снаряды «шимозе» к 75-мм полевым и горным пушкам, в которых заряд примерно 0,8 кг тринитрофенола был особым образом из расплава отлит в виде мелкозернистой массы. В этой же войне Японией были впервые применены крупнокалиберные (до 12 дюймов) снаряды корабельной артиллерии с массой заряда тринитрофенола до 41 кг, которые не могли пробить броневую защиту, но наносили значительные разрушения на палубах и показали хорошую эффективность. Русско-японская война стала апофеозом применения тринитрофенола.
Высокая активность ВВ, большое количество несчастных случаев (большое количество разрывов снарядов в стволах, да и взрыв Микасы многие приписывают капризу «шимозе»), заставили химиков многих стран искать альтернативу. Таковым стал тринитротолуол.
Военное значение тринитрофенола сохранялось ещё вплоть до Второй мировой войны, однако использовался он все меньше и меньше. Уже в Первую мировой войну, его использование было достаточно ограничено. В настоящее время привлекательность его из-за повышенной коррозионной активности и чувствительности по сравнению с тротилом невысока. В то же время относительная простота кустарного изготовления и высокая взрывная эффективность тринитрофенола привлекали и продолжают привлекать внимание террористов.
Физические свойства
Чистый тринитрофенол — твёрдое вещество в виде пластинчатых кристаллов от бесцветного до жёлтого цвета, плотность 1813 кг/м³, температура плавления 122,5 °C. Кристаллическая система орторомбическая бипирамидальная. Давление паров при 195 °C — 2 мм рт. ст., при 255 °C — 50 мм рт. ст. Плотность расплава при 124 °C 1589 кг/м³, при 170 °C — 1513 кг/м³. Гравиметрическая (насыпная) плотность порошка 900—1000 кг/м³. Порошок хорошо прессуется, особенно при подогревании. При давлении прессования 4500 кг/см² плотность 1740 кг/м³, однако в практике из соображений безопасности прессуют при давлениях до 2000 кг/см², при этом плотность не выше 1630 кг/м³. При спокойном охлаждении расплава можно получить твёрдое вещество с плотностью 1580—1610 кг/м³. Чем меньше примесей, тем выше плотность сплавленного тринитрофенола.
Химические свойства
Растворимость
В холодной воде растворяется слабо, около 1,1 % при 15 °C. В горячей воде растворимость значительно увеличивается до 6,5 % при 100 °C. По другим данным, при 20 °C растворяется 1,14 %, при 60 °C — 2,94 % и при 100 °C — 9,14 %. Водный раствор тринитрофенола окрашен в интенсивный желтый цвет благодаря присутствию аниона. Неионизированная молекула в безводных растворах цвета не имеет (например, в петролейном эфире). В присутствии сильных кислот раствор также не имеет окраски, это свойство позволяет использовать тринитрофенол в качестве кислотно-основного индикатора.
В этиловом спирте и диэтиловом эфире растворимость относительно высока. В 100 г спирта при 20 °C растворяется 6,23 г пикриновой кислоты, а при температуре кипения — 66,2 г. При 13 °C в 1 л безводного эфира растворяется 10,8 г пикриновой кислоты; при содержании в эфире 0,8 % воды растворяется 36,8 г, а присодержании 1 % воды — 40 г. Растворяется в метиловом спирте, глицерине, хлороформе, сероуглероде, ацетоне и особенно хорошо в бензоле. В 100 г бензола растворяется 3,7 г при 5 °C, 7,29 г — при 15 °C, 9,55 г — при 20 °C и 96,77 г — при 75 °C.
В смесях серной кислоты и воды растворимость заметно возрастает при концентрации кислоты выше 70 % и при увеличении температуры. При температуре 18 °C растворимость в безводной серной кислоте 10,1 г/100 мл кислоты, а при 80 °C — 25,8 г/100 мл кислоты. При разбавлении раствора в серной кислоте тринитрофенол выпадает в осадок.
Эвтектические смеси
Тринитрофенол образует со многими веществами эвтектические смеси, что широко использовалось при снаряжении боеприпасов, поскольку температура плавления чистого тринитрофенола 122,5 °C создаёт значительные технологические сложности. Наиболее привлекательными с практической точки зрения являются смеси с другими нитросоединениями:
смесь с нитронафталином 1:1, температура плавления 49 °C
смесь с тринитротолуолом 1:1, 47 °C
смесь с тринитрокрезолом 1:1, 70 °C
Взаимодействие с металлами
Тринитрофенол достаточно сильная кислота, способная к обменным реакциям с образованием солей металлов (пикратов). Наиболее часто встречаются:
пикрат натрия C6H2(NO2)3ONa
пикрат кальция (C6H2(NO2)3O)2Ca
пикрат железа (C6H2(NO2)3O)3Fe2
пикрат свинца (C6H2(NO2)3O)2Pb
Все пикраты — твёрдые кристаллические вещества, обладающие значительно более высокой чувствительностью, чем тринитрофенол. Это требует особого внимания к применению металлов и металлическим загрязнениям при его производстве. Прямое образование пикратов в среде серной кислоты не происходит, основную опасность представляют примеси в промывочной воде и материалы, с которыми контактирует очищенный тринитрофенол. Из-за повышенной чувствительности пикратов, при изготовлении боеприпасов требуются специальные меры по изоляции заряда от металлической оболочки.
Другие свойства
Характерная качественная реакция — с цианидом калия, в которой образуется ярко-красная изопурпуровая кислота.
Тринитрофенол со многими ароматическими химическими веществами образует нестойкие соединения, в которых не образуются полноценные ковалентные или ионные химические связи.
Окисляется сильными окислителями. В кипящей азотной кислоте окисляется до щавелевой кислоты. В кипящем растворе персульфата аммония полностью окисляется:
C6H2(NO2)3OH → (NH4)2S2O3 + CO2 + HNO3 + HCN
Восстанавливается сульфидом или гидросульфитом натрия, сульфатом железа до пикрамовой (picramic) кислоты, применяемой как сырьё в производстве красок и диазодинитрофенола. Дальнейшее восстановление приводит к образованию триаминофенола.
Кипячение в концентрированном растворе гидроксида натрия приводит к разложению:
C6H2(NO2)3OH → NH3 + HCN + HNO2
Взаимодействие с гипохлоритами приводит к разложению с образованием хлорпикрина, это один из промышленных способов его получения:
C6H2(NO2)3OH + 11HOCl = 3CCl3NO2 + 3 CO2 + 6H2O + 2HCl
Взаимодействие с хлором, царской водкой, хлоратом калия в присутствии HCl приводит к образованию хлоранила (chloranil) и хлорпикрина.
Взрывчатые свойства
Основные характеристики
Реакция разложения
2C6H2(NO2)3OH = CO2 + C + 10 CO +2 H2O + H2 + 3 N2
Продукты взрыва в замкнутой бомбе: 71,05 % CO, 3,42 % CO2, 0,34 % O2, 1,02 % CH4, 13,8 % H2, 21,1 % N2
Кислородный баланс при окислении до CO2 : −45 %
Расчётные характеристики для разных плотностей:
| Показатель | При плотности 1,76 г/см³ | При плотности 1,00 г/см³ |
|---|---|---|
| Состав продуктов взрыва | ||
| CO2 | 2,661 | 1,310 |
| CO | 0,179 | 2,970 |
| H2O (г) | 1,499 | 1,409 |
| N2 | 1,500 | 1,496 |
| C (тв) | 3,160 | 1,713 |
| H2 | - | 0,065 |
| NH3 | - | 0,008 |
| CH4 | - | 0,006 |
| Скорость детонации, м/с | 7680 | 5545 |
| Давление детонации, кбар | 265 | 88 |
| Теплота взрыва, ккал/г | 1,27 | 1,02 |
| Объём продуктов взрыва, см³/г | 0,423 | 0,714 |
- Скорость детонации зависит от плотности:
| Плотность, г/см³ | Скорость детонации, м/с |
|---|---|
| 0,97 | 4965 |
| 1,32 | 6190 |
| 1,41 | 6510 |
| 1,62 | 7200 |
| 1,70 | 7480 |
Зависимость скорости детонации D от плотности ρ неплохо описывается уравнением Кука (Cook): D[м/с] = 5255 + 3045 (ρ[г/см³] — 1).









